日期:2016-11-23 标签: 来源:
T细胞肿瘤免疫治疗--如何实现下一次重大突破?


----震惊世界的最初两篇CAR-T临床试验报道。
2011年夏天,宾夕法尼亚州立大学的内科医生们首先报道了3位晚期CLL患者的CD19 CAR-T治疗情况,直到现在,其中一位患者已经去世,另外两位仍然保持健康。CD19 CAR-T治疗ALL的疗效更出色,超过80%的患者能获得完全缓解CR,其中一位幸运的小女孩,Emily Whitehead,今年11岁,她在4年前因为ALL化疗失败,即将绝望的时候,被费城儿童医院的CAR-T临床试验招募,回输自体的CAR-T细胞后,虽然发生了剧烈的细胞因子风暴,却成功取得了完全缓解。从4年前接受治疗直到现在,她的体内仍然找不到癌细胞(消息来源:Jennifer Couzin-Frankel, Science, 2016)。我们可以在Emily的官方网站上关注她的最新动态。

------pictures from http://emilywhitehead.com/.
随后,基于T细胞的肿瘤免疫治疗临床试验遍地开花,也取得了相当不错的临床疗效。
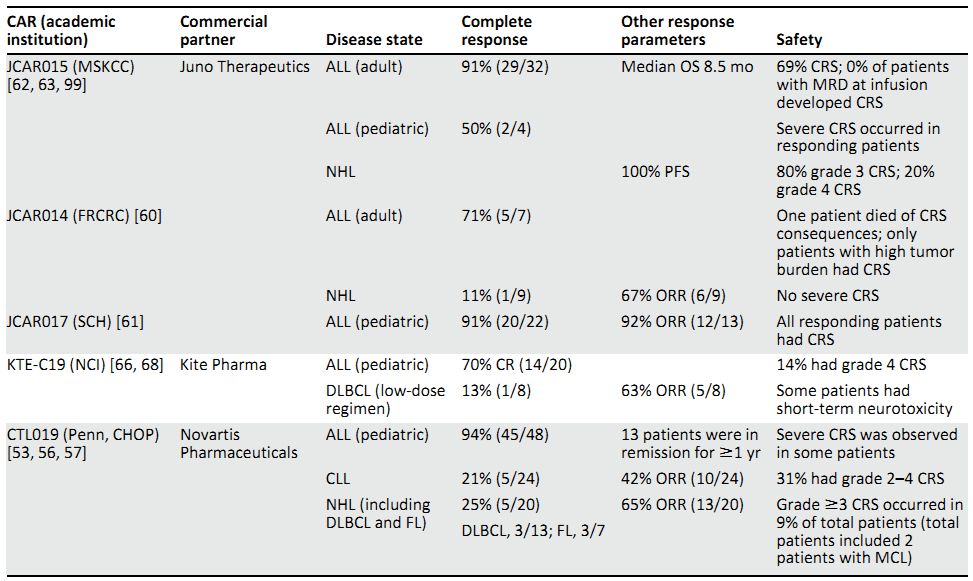
------Maus, M.V. and B.L. Levine, Chimeric Antigen Receptor T-Cell Therapy for the Community Oncologist. Oncologist, 2016.
据今年年中发表的一篇综述统计(Schubert, M.L. Hum Gene Ther, 2016.),总结了CD19 CAR-T治疗ALL,CLL,NHL的59个临床试验。临床有效率大概为:81 % of ALL, 50 % of CLL 和 40 % of NHL。疗效看起来不错,特别是ALL,基本上有效的患者都是能达到完全缓解。但是,即使是ALL的CAR-T治疗,复发率还是比较高的,据2015年美国血液学学会报道,B-ALL的复发率大概为18-36%(当然,大部分都是CD19-复发)。---Fesnak, A.D., C.H. June and B.L. Levine, Engineered T cells: the promise and challenges of cancer immunotherapy. Nature Reviews Cancer, 2016. 16(9): p. 566-581.
对于其他的血液肿瘤以及实体瘤的T细胞治疗,不单只是安全性更加难以保证,其疗效的提高更加是任重道远。例如安全性较好的一个实体瘤靶点NY-ESO-1的TCR-T细胞治疗,在滑膜细胞肉瘤和黑色素瘤中的有效率约为61%和55%,其完全缓解率则为5.6%和20%,当然同样也面临着复发的问题。----Robbins, P.F., et al., A pilot trial using lymphocytes genetically engineered with an NY-ESO-1-reactive T-cell receptor: long-term follow-up and correlates with response. Clin Cancer Res, 2015. 21(5): p. 1019-27.
如何进一步提高T细胞治疗的疗效、防止复发,是细胞治疗再次突破必须解决的难题。
对于B细胞性血液肿瘤而言,CD19-复发问题的解决方向是联合多靶点特异性的CAR进行治疗,这是无可非议的。B细胞血液肿瘤另外的靶点还有CD20,CD123等。CD20特异性CAR已经在进行临床试验,并且取得了一定的疗效。----Wang, Y., et al., Effective response and delayed toxicities of refractory advanced diffuse large B-cell lymphoma treated by CD20-directed chimeric antigen receptor-modified T cells. Clinical Immunology, 2014. 155(2): p. 160-175.
CD19和CD123双特异性CAR也即将进入临床试验阶段。----Ruella, M., et al., Dual CD19 and CD123 targeting prevents antigen-loss relapses after CD19-directed immunotherapies. J Clin Invest, 2016.
许多其他的靶点也在研发阶段,而它们各自的安全性、有效性如何,还是需要一个一个地探索。
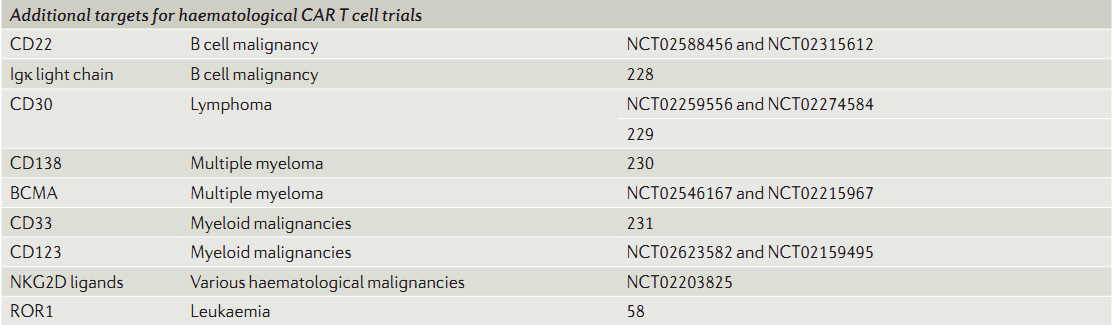
----Fesnak, A.D., C.H. June and B.L. Levine, Engineered T cells: the promise and challenges of cancer immunotherapy. Nature Reviews Cancer, 2016. 16(9): p. 566-581.
新靶点的开发与联合应用固然重要,但是如果不能把经典靶点的T细胞治疗的疗效进一步提高(例如CD19 CAR-T和NY-ESO-1 TCR-T),新靶点以及多靶点的T细胞治疗疗效也很难出现新的突破。
改善T细胞治疗疗效的策略也有很多,下面将会一一介绍。
l 首先是CAR结构设计的改进。
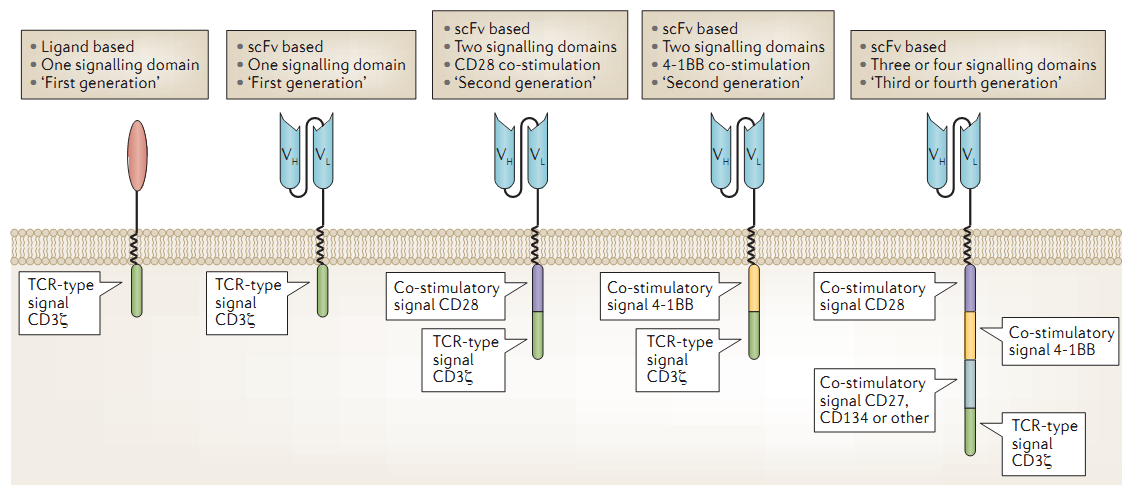
----Fesnak, A.D., C.H. June and B.L. Levine, Engineered T cells: the promise and challenges of cancer immunotherapy. Nature Reviews Cancer, 2016. 16(9): p. 566-581.
把共刺激受体的信号肽引入CAR的结构中是CAR-T领域上最成功的改进。现在大家喜闻乐见振奋人心的CAR-T临床试验报道都是经过这次改进之后的结果。在这之前,只有scFv片段和CD3ζ链的CAR基本上有任何临床疗效。----Savoldo, B., et al., CD28 costimulation improves expansion and persistence of chimeric antigen receptor-modified T cells in lymphoma patients. J Clin Invest, 2011. 121(5): p. 1822-6.
除了信号肽,CAR结构中的连接片段的设计对其功能也具有重要的影响。如下图中右边两个是linker片段经过优化后的CAR,其体内存活能力和肿瘤杀伤功能都得到了改善。
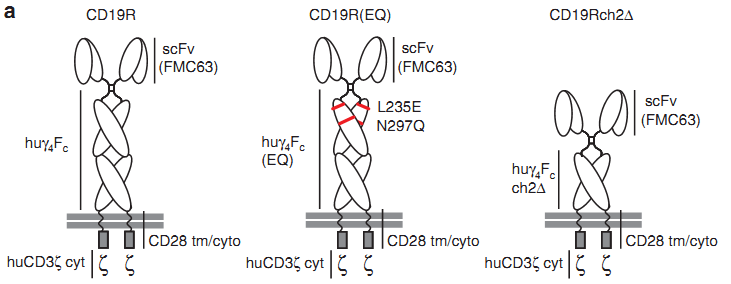
----Jonnalagadda, M., et al., Chimeric antigen receptors with mutated IgG4 Fc spacer avoid fc receptor binding and improve T cell persistence and antitumor efficacy. Mol Ther, 2015. 23(4): p. 757-68.
l 第二个方向是赋予T细胞额外的功能。
我们给T细胞过表达CAR和TCR,就相当于赋予其肿瘤特异性的功能,再通过CAR设计上的改进,取得了今时今日的疗效。但是我们能否通过同时过表达其他的基因来进一步增强T细胞的功能呢?这个策略在临床前研究已经取得了一定的成果。
举个例子,给CAR-T细胞额外共表达CD40L,通过CD40/CD40L信号,一来可以提高肿瘤细胞的免疫原性,诱导机体本身的抗肿瘤免疫应答,二来可以激活树突状细胞,使其上调一系列共刺激分子、粘附分子和抗原递呈功能,进而加强了T细胞应答和记忆形成。
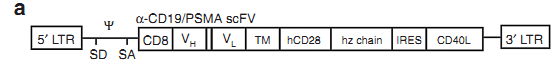
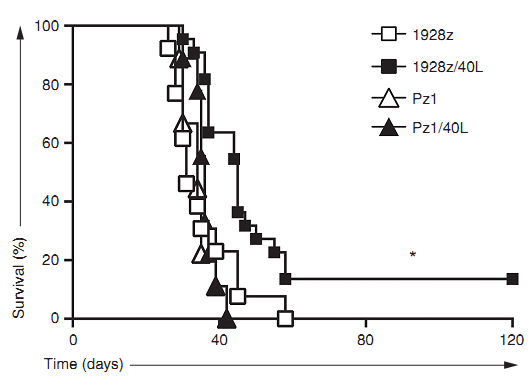
----Curran, K.J., et al., Enhancing antitumor efficacy of chimeric antigen receptor T cells through constitutive CD40L expression. Mol Ther, 2015. 23(4): p. 769-78.
再例如,给T细胞共表达CAR和肝素酶HPSE,可以赋予其降解硫酸乙酰肝素蛋白聚糖的能力(细胞外基质的主要成分),因而改善了CAR-T细胞浸润肿瘤和杀伤肿瘤的能力。
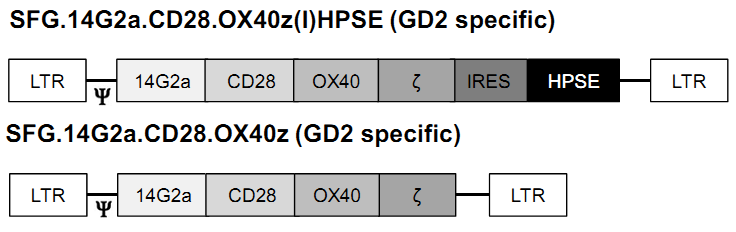
----Caruana, I., et al., Heparanase promotes tumor infiltration and antitumor activity of CAR-redirected T lymphocytes. Nat Med, 2015.
另外,共表达CAR和catalase过氧化物酶,赋予其代谢H2O2的功能,提高抗氧化能力,使其能够在高H2O2的环境中发挥抗肿瘤功能。甚至还可以保护其周围的免疫细胞免受H2O2的抑制,恢复其抗肿瘤功能。
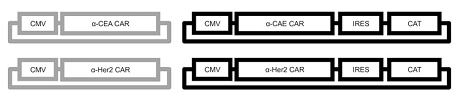
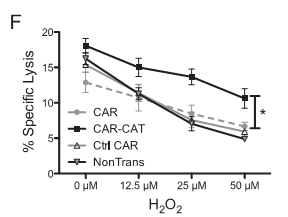
---- Ligtenberg, M.A., et al., Coexpressed Catalase Protects Chimeric Antigen Receptor-Redirected T Cells as well as Bystander Cells from Oxidative Stress-Induced Loss of Antitumor Activity. J Immunol, 2016. 196(2): p. 759-66.
l 第三个方向是T细胞临床治疗方案的改进。
这包括回输前化疗方案的改进和联合其他治疗方法等。联合应用抗PD-1/PD-L1抗体治疗是其中一个倍受关注的策略,目前仍处于临床前研究阶段。
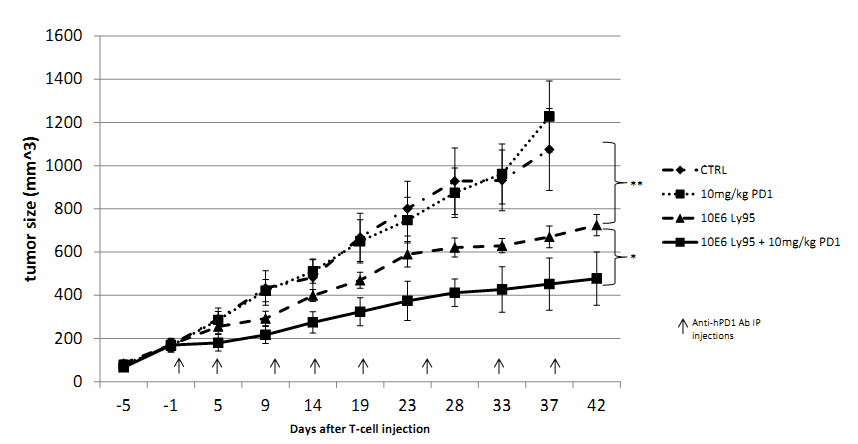
---- Moon, E.K., et al., Blockade of Programmed Death 1 Augments the Ability of Human T cells Engineered to Target NY-ESO-1 to Control Tumor Growth after Adoptive Transfer. Clin Cancer Res, 2015.
l 第四个方向是对T细胞本身进行调控。
这主要包括表型的调控和代谢的调控。T细胞表型调控主要包括CD4,CD8比例的控制和追求表型更“年轻”T细胞。Fred Hutchinson Cancer Research Center的CD19 CAR-T临床试验使用的就是用起始细胞表型统一的T细胞来制备CAR-T,且控制回输时CD4:CD8为1比1,相对于其他未控制表型的临床试验,其优势是在研究疗效和副作用相关因素的时候可以减少表型不确定造成的干扰,更重要的是,据最新临床试验报道,该策略治疗非霍奇金淋巴瘤的完全缓解率在部分实验组能高达前所未有的64%。这可能是使CAR-T治疗疗效再次突破的一次改进。----Turtle, C.J., et al., Immunotherapy of non-Hodgkin's lymphoma with a defined ratio of CD8+ and CD4+ CD19-specific chimeric antigen receptor-modified T cells. Sci Transl Med, 2016. 8(355): p. 355ra116.z
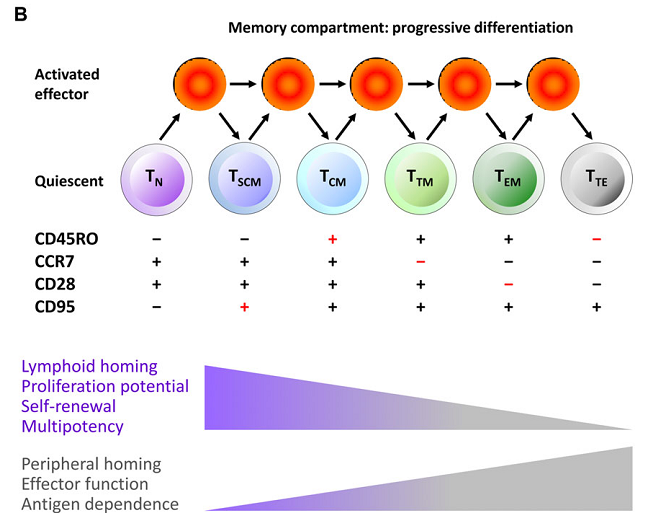
----Mahnke, Y.D., et al., The who's who of T-cell differentiation: Human memory T-cell subsets. European Journal of Immunology, 2013. 43(11): p. 2797-2809.
其他的调控T细胞表型的方式还有在培养T细胞过程中采用不同的活化方式、细胞因子等,值得关注的是细胞因子组合IL-7和IL-15有助于培养表型“年轻”的T细胞,但是这些改进尚未在临床试验中取得较大的突破。
把代谢调节应用到T细胞肿瘤免疫治疗是未来的发展方向之一。T细胞代谢与其生存、增长、分化和效应功能息息相关。不少临床前研究已经发现了通过调节某些代谢程序可以增强T细胞的抗肿瘤功能,以及具有某些代谢特征的T细胞可能更适合用于肿瘤免疫治疗。
例如通过基因敲除或者药物抑制胆固醇酯化关键酶ACAT1,都能增强CD8+ T细胞的效应功能和增值能力。其机制是通过增加CD8+ T细胞膜胆固醇水平引起TCR聚集和信号传导的加强,以及更有效地形成免疫突触。---- Yang, W., et al., Potentiating the antitumour response of CD8(+) T cells by modulating cholesterol metabolism. Nature, 2016. 531(7596): p. 651-5.
再例如,研究发现线粒体膜电位较低的T细胞具有更明显的记忆细胞表型,其在体内的复制能力和抗肿瘤能力也更加出色。若把这些特殊的T细胞分选出来,制备CAR-T或者TCR-T细胞,或许可以进一步改善临床疗效。
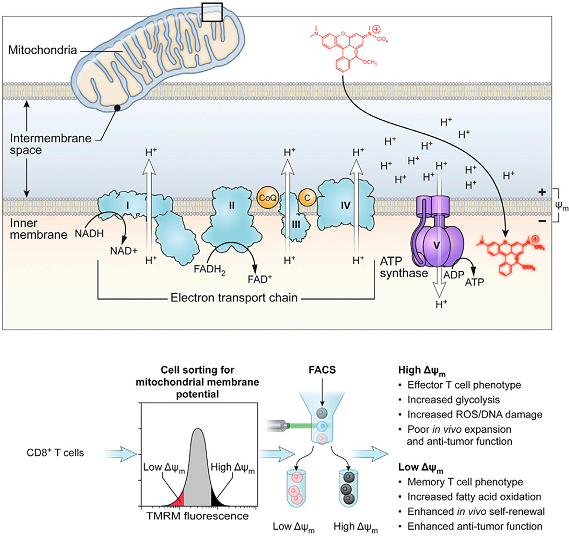
---- Sukumar, M., et al., Mitochondrial Membrane Potential Identifies Cells with Enhanced Stemness for Cellular Therapy. Cell Metabolism, 2016. 23(1): p. 63-76.
总结
T细胞肿瘤免疫治疗发展至今已经有30余年的历史,从最初的LAK技术、CIK技术,发展到今天的CAR-T, TCR-T技术,其真正开始飞速发展是在最近这5年。T细胞治疗技术的适用面也越来越广,除了适用的肿瘤类型不断增加,还逐渐渗透到病毒感染、自身免疫疾病的治疗当中。该技术仍然处于蓬勃发展的年轻时期,有很大的改进空间,至于如何发展,也有无数的可能性,让我们拭目以待。