日期:2021-03-05 标签:行业新闻 来源: Insight数据库
2021年2月6日,FDA 官网显示,百时美施贵宝旗下公司 Juno Therapeutics 的嵌合抗原受体 T 细胞(CAR-T)产品 Breyanzi(lisocabtagene maraleucel)获批上市,用于治疗复发/难治性大 B 细胞淋巴瘤。这是全球范围内第 4 款获批上市的 CAR-T 疗法药物。

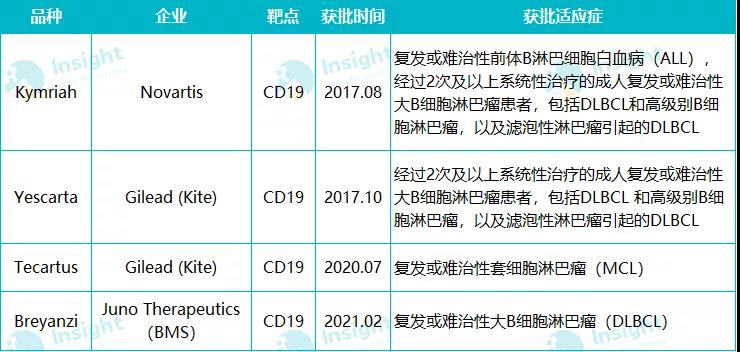
Breyanzi (研发代号:JCAR017)是一款靶向 CD19 的 CAR-T 疗法,通过收集患者自体 T 细胞并进行修饰,使其靶向淋巴瘤细胞,达到杀灭病灶的作用。此前,已有三款获 FDA 批准上市的 CAR-T 细胞免疫治疗产品,包括 Kite 制药的 Yescarta 和 Tecartus 以及诺华的 Kymriah,三者均靶向 CD19。其获批时间及适应症详情如下图:
全球获批的 4 款 CAR-T 产品(Insight 数据库制图)
在 TRANSCEND NHL 001 临床研究中,73% 的患者达到了缓解(95%CI:67%-80%),其中 54% 的患者完全缓解(CR;95%CI:47%-61%),19% 部分缓解(PR;95%CI:14%-26%)。所有发生应答的患者的缓解持续时间中位值为 16.7 个月(95%CI:5.3 – NR)。在接受 Breyanzi 治疗应答最佳的 104 位患者中,65% 的缓解持续了至少 6 个月,而 62% 的缓解持续了至少 9 个月。
在安全性方面,接受 Breyanzi 治疗的不良反应主要为细胞因子释放综合征(CRS)和神经毒性(NT)。46%(122/268)的患者发生了 CRS,其中 3 级以上 4%(11/268),CRS 的中位发病时间和中位持续时间均为 5 天。35%(95/268)的患者发生了神经毒性(NT),12%(31/268)3 级以上,其中 85%(81/95)的神经毒性可有效控制,持续中位时间为 12 天。
基于 Breyanzi 的优异临床效果,FDA 此前曾授予该产品孤儿药认定、突破性疗法认定以及再生医学先进疗法认定(RMAT)。Breyanzi 是首个获 FDA RMAT 认证的再生医学疗法。